Introduzione
Sei all’inizio dei tuoi studi e hai bisogno di sapere cosa sono gli alcani, ma la chimica organica ti spaventa? Bene, questo articolo fa al caso tuo, perché con parole semplici e poche chiacchere vedremo i concetti base da sapere per il tuo esame.
Cosa sono gli alcani?
Gli alcani sono le più semplici tra le molecole organiche, formate solo da idrogeno, H, e carbonio, C, legati tra loro mediante legami semplici. Essi sono definiti come
le molecole con formula molecolare CnH2n+2
dove n è un numero qualsiasi intero. Perciò se n=1, la formula che otteniamo è CH4, il metano, la molecola più semplice della chimica organica. Progredendo con il numero n, otteniamo gli altri alcani successivi al metano:
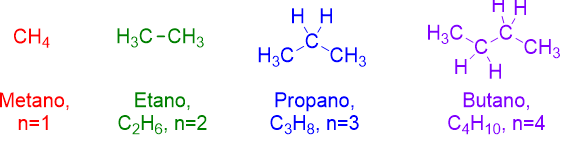
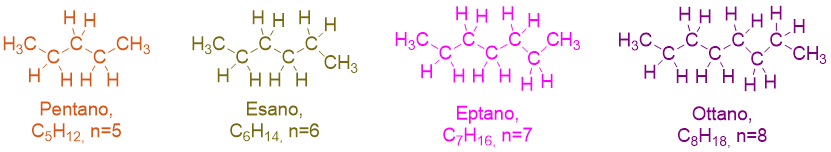
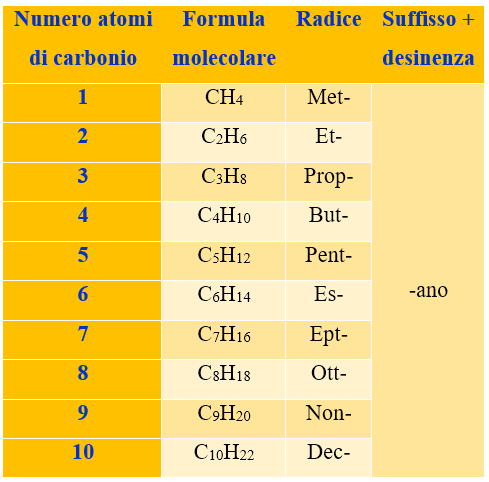
Come si vede dalla figura il nome dei primi 4 alcani, è dato dalla radice MET-, ET-, PROP-, BUT- + il suffisso –AN che indica alcano, appunto, + la desinenza O o I a seconda che il nome sia singolare o plurale. Sfortunatamente queste radici sono da imparare a memoria, perché non c’è nulla che veramente le leghi alla struttura della molecola, se non il suffisso e desinenza –ano, che è caratteristica degli alcani. Ma la buona notizia è che i nomi degli alcani successivi sono facili da ricavare. Infatti si usano i prefissi numerali greci (pent-, es-, ept-, ott-, non-, dec-, etc.) per indicare il numero di atomi di carbonio presenti, seguiti dalla solito suffisso e desinenza –ano (vedi Figura 2 e Tabella 1).
Geometria degli alcani
Il carbonio negli alcani forma sempre 4 legami semplici, rispettando la sua valenza pari a 4. L’idrogeno, come al solito, invece fa solo un legame, avendo valenza 1. Ricordarsi la valenza può essere utile per scrivere correttamente le formule di struttura di questi composti. Andiamo però più a fondo nel capire come fa il carbonio a legarsi. Prendiamo la configurazione elettronica esterna del carbonio:
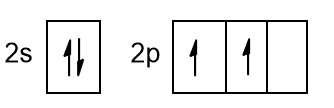
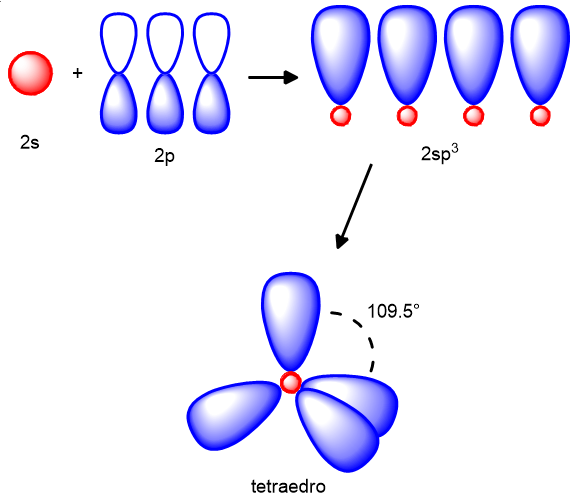
Dalla figura 3 si apprende come il carbonio abbia 2 elettroni appaiati nell’orbitale 2s e 2 spaiati in due orbitali p, mentre l’ultimo orbitale p è vuoto. Con tale configurazione il carbonio potrebbe fare solo due legami, condividendo gli elettroni spaiati degli orbitali p o al massimo potrebbe fare 3 legami se usasse anche l’orbitale vuoto per accettare una coppia di elettroni da un atomo esterno. Ci rendiamo subito conto che tale configurazione, non spiega in nessun modo la valenza 4 del carbonio negli alcani. Per spiegare tale fenomeno, i chimici hanno introdotto il concetto di ibridazione degli orbitali.
In particolare, secondo questa teoria, uno degli elettroni del 2s viene promosso nell’orbitale vuoto del 2p (Figura 4), destabilizzando leggermente l’atomo.

Grazie a questa promozione, ora ci sono 4 elettroni spaiati nei quattro orbitali. Tali orbitali vengono ora mescolati insieme a formare altri 4 orbitali detti ibridi sp3. Essi sono orbitali con caratteristiche a metà tra quelle degli orbitali p (bilobati) e quelle dell’orbitale s (sferico) (vedi Figura 5). È avvenuta una specie di fusione, come quella che tra Goku e Vegeta dava vita a un essere ibrido Vegekou, per gli amanti della saga televisiva Dragonball. Tali orbitali ibridi sono pronti a legarsi a altri 4 atomi esterni (altri atomi di carbonio e/o idrogeno) in modo che il carbonio acquisti la stabilità data dal raggiungimento dell’ottetto. I legami saranno tutti legami semplici noti con il termine legami σ. La geometria molecolare di un carbonio ibrido sp3 è il tetraedro con angoli di 109.5° tra i legami (Figura 5).
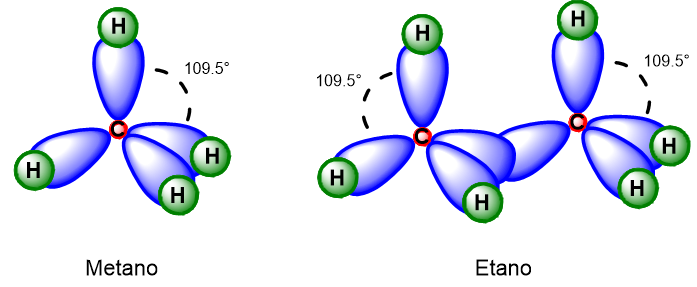
Grazie alla teoria dell’ibridazione sappiamo ora esattamente la geometria molecolare di tutti gli alcani (geometria tetraedrica), tutti gli angoli di legame (sempre 109.5°) e i tipi di legame (tutti legami singoli, detti σ). Facciamo un esempio, prendiamo il metano, CH4, sappiamo che il carbonio è ibridato sp3 e che i suoi orbitali si disporranno ai vertici di un tetraedro per legarsi agli orbitali 1s di 4 idrogeni (Figura 6). Gli angoli di legame sono tutti 109.5°. Allo stesso modo nell’etano, C2H6, i due carboni sono ibridi sp3 e si legheranno tra loro tramite un legame singolo σ e ai rimanenti orbitali legheranno tanti idrogeni quanti necessari per far reagire tutti i restanti orbitali ibridi (Figura 6).
Ragionamenti simili si possono usare per costruire gli alcani di ordine superiore (propano, butano, etc.).
Isomeria strutturale
Dalla chimica generale saprai che gli isomeri strutturali sono molecole con la stessa formula molecolare, ma diversa formula di struttura. Nella chimica organica questo argomento non è solo una nozione sospesa in aria, ma è una realtà importante per l’attività di laboratorio. Infatti gli alcani possono presentare questo tipo di isomeria a partire dal butano. Metano, etano e propano non presentano isomeria strutturale, perché non è possibile connettere gli atomi in modo diverso.
Prima di passare agli isomeri, vediamo un concetto che ci può aiutare a individuarli: la nomenclatura dei carboni della catena alchilica. Si distingue tra:
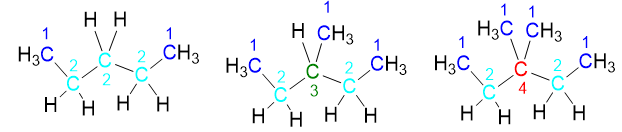
- Carboni primari (CH3-) quelli esterni alla catena che legano un solo altro atomo di carbonio (Figura 7);
- Carboni secondari (-CH2-), quelli interni alla catena che legano ben altri due atomi di carbonio;
- Carboni terziari (-CH-), quelli interni alla catena, ma che legano tre atomi di carbonio.
- Carboni quaternari (-C-), interni alla catena, che legano il massimo possibile di atomi di carbonio, ossia 4. Tali carboni ovviamente non possono legare alcun idrogeno, avendo saturato la valenza.
Ora possiamo individuare gli isomeri. Partiamo dal butano, il primo degli alcani a presentare isomeria strutturale. Tale composto ha formula molecolare C4H10, tuttavia è possibile scrivere due isomeri con la stessa formula molecolare:
- il normale butano (abbreviato a n-butano) a catena lineare;
- l’isobutano, (abbreviato a i-butano)a catena ramificata.
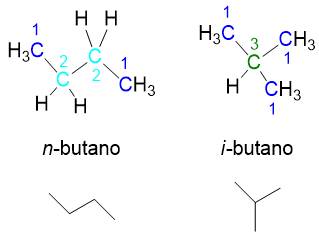
In figura 8 si vede che il normale butano è caratterizzato solo da carboni primari e secondari e ha una catena lineare, come si vede meglio dalla formula di struttura ‘’scheletrica’’ in basso che riporta solo i legami carbonio-carbonio, omettendo il resto. L’isobutano, invece, ha 3 carboni primari e un carbonio terziario; la catena risulta meno lineare, come si vede meglio dalla formula di struttura scheletrica in basso. Ciò che è cambiato dal normale butano all’iso è la posizione di un CH3 che è andato a legarsi a un carbonio interno, generando un carbonio terziario. L’isobutano può essere visto anche come un propano con un sostituente metilico sul carbonio interno, infatti il nome IUPAC di tale composto è 2-metilpropano.
Ovviamente il numero degli isomeri strutturali sarà maggiore quanto più lunga sarà la catena alchilica. Per imparare a scrivere gli isomeri basterà scrivere prima l’isomero a catena lineare, il più semplice, e poi costruire gli altri, prendendo dei pezzi esterni dell’isomero lineare (es. un CH3, un CH2-CH3 etc.) e legandoli a dei carboni interni fino a esaurire tutte le possibilità. Per sapere se il lavoro è stato eseguito correttamente, controllate che la tipologia di carboni (primario, secondario, terziario, quaternario) sia effettivamente cambiata da un isomero all’altro.
Facciamo un ultimo esempio prendendo la molecola successiva al butano, il pentano C5H12. Scriviamo dapprima l’isomero lineare, che avrà solo carboni secondari e primari. Tale isomero è il normale pentano, n-pentano.
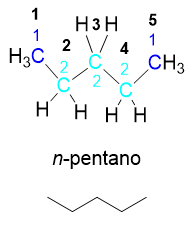
Se a tale isomero prendo un -CH3 esterno e lo sposto sul -CH2– interno con numero progressivo 3, otterrò il secondo isomero strutturale: l’isopentano, i-pentano o 2-metilbutano. Come si vede in figura tale isomero ha un carbonio terziario, oltre ai carboni secondari e primari, mentre il normal pentano aveva solo carboni secondari e primari. Dunque siccome il tipo di atomi di carbonio è cambiato, siamo sicuri di essere davanti a un isomero.
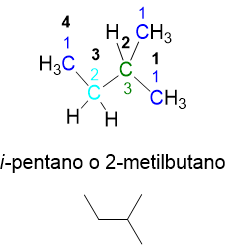
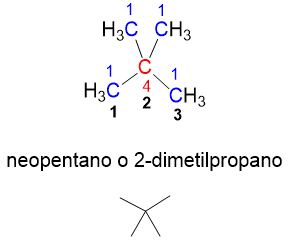
Non è ancora finita però, infatti se all’isopentano prendiamo un metile esterno, per esempio il metile n. 4 della catena e lo spostiamo sul carbonio n.2 (numero in nero), otteniamo una nuova struttura (Figura 11). Tale struttura è difatti un nuovo isomero (neopentano) perché ha solo carboni primari e un carbonio quaternario, situazione molto diversa dal isopentano.
Passando dall’isomero lineare a quelli ramificati, ci si accorge come la catena lineare principale via via si accorci; infatti siamo passati da una catena a 5 atomi di carbonio (vedi numeri in nero nelle figure) nel n-pentano a una a 4 atomi nell’i-pentano, fino a soli 3 atomi per il neopentano.
Abbiamo quindi visto la strategia per scrivere gli isomeri, per capire meglio dovrai necessariamente allenarti. Per esempio prova a scrivere gli isomeri strutturali per l’esano e fai il nostro quiz.
Proprietà fisiche degli alcani
Punti di ebollizione e fusione
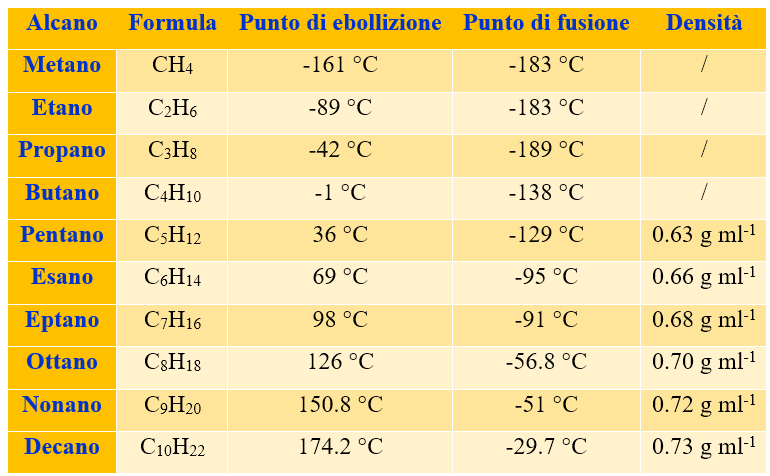
I primi quattro alcani (dal metano al butano) sono dei gas, il pentano è invece un liquido basso bollente (p.eb. = 36°C). Gli alcani dal pentano fino all’ eptadecano (C17H36) sono dei liquidi; invece dall’ottadecano (C18H38) in poi diventano solidi.
Da questo andamento si capisce facilmente che con l’allungarsi della catena, i punti di ebollizione aumentano. Infatti più la catena alchilica è lunga, maggiori saranno le interazioni di Van der Waals tra una catena e l’altra. Si veda la tabella sottostante.
La presenza di una ramificazione abbassa il punto di ebollizione perché la ramificazione rende l’area di contatto tra una molecola e l’altra inferiore, riducendo le attrazioni di Van der Waals. Come esempio si considerino gli isomeri del pentano (Figura 12). Si vede che il neopentano, più ramificato, è un gas a temperatura ambiente, mentre il n-pentano con catena lineare è un liquido basso bollente.
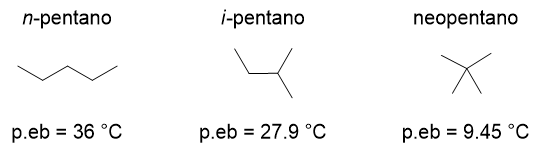
Per quanto riguarda i punti di fusione l’andamento non è così regolare come per i punti di ebollizione. Tuttavia è possibile vedere un trend se distinguiamo tra alcani con numero pari di atomi di carbonio e alcani a numero dispari di atomi di carbonio.
Gli alcani a numero pari di atomi di carbonio allo stato cristallino mostrano un impacchettamento più compatto di quello degli alcani con numero dispari, presentando così punti di fusione più alti. Infatti il loro impacchettamento compatto rende migliori le interazioni di Van der Waals. Viceversa gli alcani a numero dispari di atomi di carbonio hanno punti di fusione più bassi.
In entrambe le serie, però, si registra un aumento dei punti di fusione con l’aumentare della lunghezza della catena, come per i punti di ebollizione. Le ramificazioni in genere abbassano i punti di fusione, con l’eccezione di quelle ramificazioni che conducano a una struttura più simmetrica, in tal caso il punto di fusione aumenta. Vediamo i punti di fusione degli isomeri del pentano: l’isopentano, che ha una ramificazione, ha un punto di fusione più basso del normale pentano, ma il neopentano ha il punto di fusione più alto della serie. Questo perché le due ramificazioni presenti, conducono a una struttura simmetrica, tipo pallina, che si impacchetta meglio nei reticoli cristallini del solido.
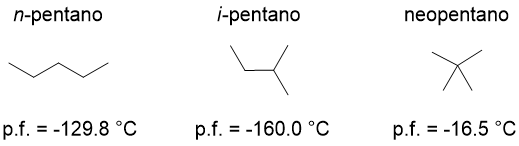
Densità
Gli alcani sono i composti a densità più bassa; hanno, infatti, densità nettamente inferiore all’acqua su cui vi galleggiano (vedi Tabella 2).
Solubilità
Usando la regola del simile scioglie il simile, si può facilmente dedurre che gli alcani sono insolubili in acqua, la cui molecola H2O non ha nemmeno un atomo di carbonio; mentre sono solubili in molti solventi organici come benzene, tetracloruro di carbonio, cloroformio. Tutti gli alcani liquidi, inoltre, sono solubili tra loro in tutte le proporzioni.
Reattività
Gli alcani sono veramente poco reattivi, giacché i legami C-C e C-H sono abbastanza forti. Quindi ci sono solo due reazioni principali per questa classe di composti:
- la combustione
- l’alogenazione
La combustione
La combustione degli alcani è una reazione di elevato interesse economico, dato che è alla base della produzione della maggior parte dell’energia che usiamo quotidianamente. Si pensi al petrolio, che è costituito principalmente da idrocarburi, quindi alcani, di diversa lunghezza. Il diesel e la benzina, derivati del petrolio, sono usati quotidianamente per alimentare i motori a scoppio dei nostri mezzi di trasporto. Il metano, inoltre, è la molecola che sprigiona più calore di combustione rispetto a tutti gli alcani successivi, dato che ha il massimo numero di legami C-H, da cui si trae più energia. Ecco perché il metano è così importante e possiamo usare lo slogan: ‘’il metano ti dà una mano!’’.
Per capire di più, vediamo in dettaglio la reazione di combustione.
Una generica reazione di combustione di un alcano, prevede la sua reazione con l’ossigeno a dare anidride carbonica e acqua.
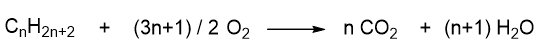
Questa reazione è esotermica, per cui sviluppa calore. Dai calori di reazione degli alcani si può comprendere la stabilità dell’alcano stesso. Più è alto il calore di reazione sviluppato dalla reazione, più l’alcano è instabile. Tuttavia si possono confrontare direttamente solo i calori di reazione generati da alcani che siano isomeri strutturali, dato che questi nella combustione danno origine alla stessa quantità di CO2 e H2O. Per esempio prendiamo gli isomeri del butano e scriviamone l’ossidazione.
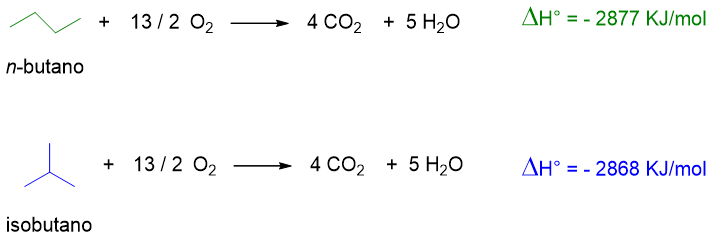
Si vede che il butano lineare libera più calore rispetto al suo isomero ramificato. Questo implica che il normal butano abbia un’energia superiore e che quindi sia più instabile dell’isobutano, come si può vedere dallo schema sottostante (Figura 16).
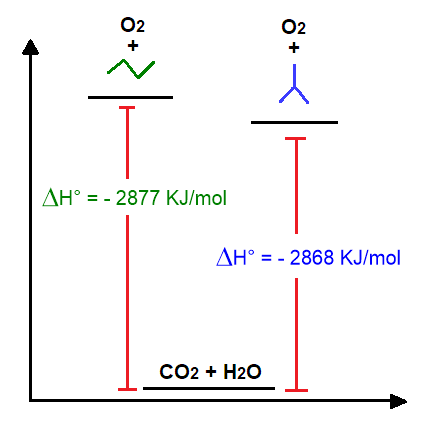
La tabella sottostante riporta i calori di reazione per la combustione dei primi dieci alcani. Quello che si nota è che la differenza tra due alcani consecutivi, con un solo CH2 di differenza, hanno tutti più o meno un valore pari a 658 kJ/mol. Questo implica che un CH2 in più contribuisce in media a un valore extra di 658 kJ/mol al calore di combustione di un alcano. Quindi si può prevedere il calore di combustione degli alcani successivi semplicemente aggiungendo 658 kJ/mol per ogni CH2 in più.
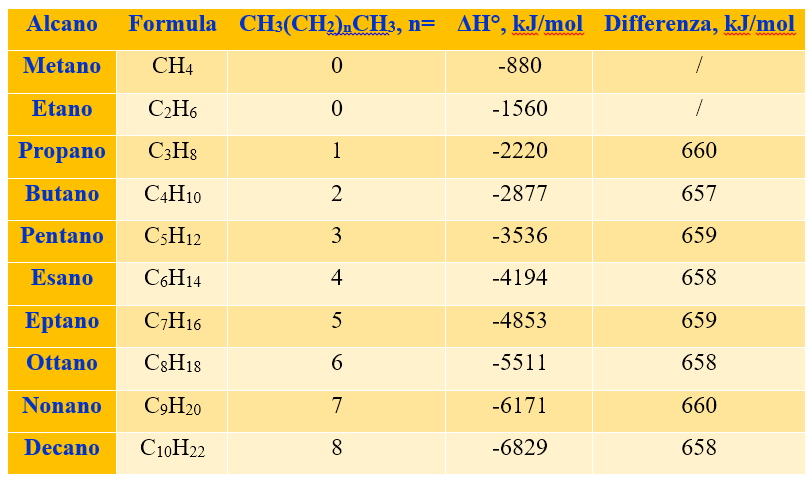
Dalla tabella si vede inoltre che il metano ha il calore di combustione più basso della serie, questo apparentemente sembrerebbe una contraddizione allo slogan: ‘’il metano ti dà una mano’’, menzionato poco sopra. In realtà a parità di atomi di carbonio il metano è quello che sprigiona più calore. Per avere un’idea approssimativa si può dividere il calore di combustione per il numero di atomi di carbonio presenti nella catena e confrontare il dato ottenuto con il calore di combustione del metano. Per esempio se prendiamo l’entalpia di combustione del decano (-6829 kJ/mol) e la dividiamo per 10 (numero di atomi di carbonio), otteniamo 682.9 kJ/mol, un valore nettamente più basso del calore sprigionato dal solo metano (-880 kJ/mol).
L’ alogenazione
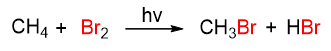
L’altra reazione degli alcani è l’alogenazione, che consiste nella reazione dell’alcano con un alogeno (F2, Cl2, Br2, I2) a dare un alogenuro alchilico. Prendiamo come esempio la bromurazione del metano. La reazione per avvenire ha bisogno di un innesco dato da una radiazione (hv) o da calore; i prodotti che si formano sono bromometano e acido bromidrico.
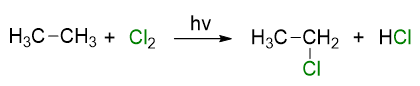
Similmente se effettuiamo la clorurazione dell’etano, otterremo cloroetano e acido cloridrico e così via per le alogenazioni degli alcani successivi. Il prodotto è sempre un alogenuro alchilico e acido alogenidrico.
La reazione con F2 è troppo reattiva e pericolosa, quindi ha scarso valore sintetico. La reazione con I2 invece è talmente lenta che impiegherebbe anni per avvenire, dunque anche questa non trova applicazione. Le uniche alogenazioni veramente di qualche utilità sono quelle con cloro e bromo.
Questa lezione

GLI ALCANI
€
1.50
Scarica pdf (non modificabile)

GLI ALCANI
€
2.20
Scarica docx (modificabile)



